在本篇博客文章中,我们将讨论如何从头开始建立电化学和电池模型的一般过程,并以柠檬电池为示例来演示建模过程。
柠檬电池简介
柠檬电池是学校化学课中的一个经典实验。使用一个柠檬、一块铜(例如,一枚硬币或一些铜线)和一块锌(例如,镀锌的钉子),可以制造一个能为小型电子设备供几分钟电的电池。但是,众所周知,这种电池的适用性受到限制,因为它的功率只有几毫瓦(mW)左右。

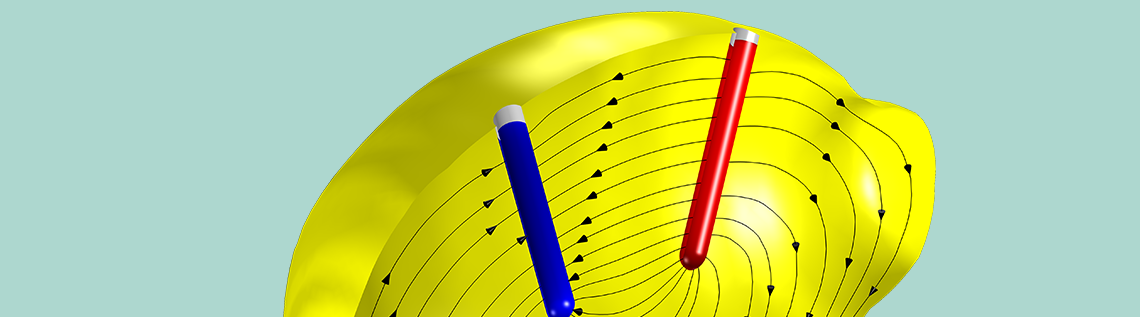
带有两个电极的柠檬(左:铜;右:锌)。
建模目标
在建模之前,建模人员应该提出的第一个问题是:我们这个项目的建模目标是什么?这看似微不足道,但如果在这个问题上花点时间,通常可以节省很多时间。
对于本文的示例,我们将解决以下问题:柠檬电池随时间的输出功率受到什么限制,如何加以改进?
换句话说,就是我们希望把这个模型用作一个设计工具,以将电池功率提高到 1 mW 以上。而其他常见的建模目标可能是减少体积、重量和(或)成本。
功率输出与电极终端上的电压和电流直接相关。这意味着我们的模型需要包括电池中电压源和引起电压损耗的主要来源,而估算电流意味着也需要以某种方式考虑电荷(离子和电子)的传输。此外,时间也是必不可少的,这意味着我们需要包括瞬态变化。
我们可以采取什么措施来提高功率?有时一开始很难知道,但考虑到材料(柠檬、铜和锌)本身就是设计的约束,因此我们可以做出一个可能的假设:提高柠檬电池性能的唯一方法是改变电极的几何结构。
综上可知,我们需要定义一个与时间和空间有关的模型。
化学物质和反应
现在,我们来讨论要在模型中添加哪些化学物质和反应。
在查看柠檬的营养信息后,我们发现电解液由柠檬酸(300 mM = 0.3 mol/L)和抗坏血酸(3 mM)组成,它们都是弱酸,缓冲至 pH 值在 2 左右(对应质子浓度为 10 mM)。电解液中还有其他离子的混合,最主要的阳离子是钾(35 mM)和钙(7 mM)。在插入电极之前,柠檬中已经存在痕量的锌(9μM)和铜(6μM)离子。除此之外,因为存在大量阴离子(例如氯离子)与阳离子匹配,所以本体电解液经常是呈现电中性的。
鉴于两个电极分别由金属铜和锌组成,并且它们可能会溶解,因此以下电极反应似乎值得进一步分析:
接下来,我们将根据柠檬的营养信息使用能斯特方程计算指定浓度下的平衡电位,Eeq。电极反应式中我们用了双向箭头,表明反应是完全可逆的,并且可以在任何方向进行。
由于电解液是含水的,而水在整个柠檬中均匀地发生自电离作用,因此存在质子和氢氧根离子:
但是,由于 pH 值是酸性的,我们认为氢氧根离子浓度可以忽略不计。
在水性体系中,可能会形成金属氢氧化物。但是,查阅锌和铜的Pourbaix图可以发现,由于 pH 值较低,不太可能在柠檬中形成金属氢氧化物。
电解液是水性的,这意味着由于电极电势的存在,氧和氢都可能在电极上形成或消耗:
这两个反应都可能在两个电极上发生,尽管我们通常假设铜电极上的动力学更快。
在柠檬的营养信息清单中,我们发现钾和钙的标准溶出电位远低于锌和铜的溶出电位,这意味着它们不会大量沉积在任何电极上。同样,氯气析出的标准电位要高于氧气,因此在本模型中也可以忽略不计。
多种不同金属离子的存在与混合电极电位的结合,导致可能产生相当复杂的金属沉积副反应系统,特别是在锌电极上。例如,柠檬中的痕量铜离子或任何其他贵金属离子可能会沉积在锌电极上。这可能会改变该电极的电催化性能,例如,沉积的铜可能会显著增加析氢的活性。在这一点上,我们选择忽略这些影响,并假设金属铜和锌的沉积溶解仅在其各自的电极上发生。
弱酸(柠檬酸和抗坏血酸)分子相对较大且复杂,通常会导致动力学变慢,我们简单地假设它们在电极上不发生反应。此外,我们还忽略了弱酸与金属阳离子络合物的形成。至于营养清单上的其他种类(糖、脂肪等),我们也予以忽略。
电解液传输
现在,我们来看看电解液中的传输过程。
首先,我们需要确定电解液中电荷传输和电位的模型,因为电解液电位和金属电位之间的电位差是电极反应的主要驱动力。
由上文可知,大量的离子(K+, Cl–等)不参与电极反应,这允许我们进行支持电解质假设,即电解液的电导率不随着电极反应而显著变化。因此,我们可以假设电导率恒定(0.35 S/m),并使用欧姆定律的偏微分方程求解电解液电位。
参与电极反应的离子包括 Cu2+,Zn2+,H+,H2和 O2,因此需要在模型中以某种方式定义这些物质的浓度(化学活度)。
Zn(s) 和 Cu(s) 的化学活度为常数 1,无需进一步处理。我们还假设电极的形状不会由于金属的溶解而改变。
与纯水(55.5 M)相比离子浓度低,我们可以假设电解液被稀释了。这意味着我们可以假设电解质仅与作为溶剂的水分子相互作用。
使用稀溶液假设,可以使用Nernst–Planck(能斯特-普朗克)方程定义 Zn2+和 Cu2+的传输,这里我们只需要为每个离子设定一个扩散率/迁移率参数。
由于弱酸(柠檬酸和抗坏血酸)具有 pH 缓冲能力且不参与电极反应,因此我们假定pH值恒定(氢浓度)。
柠檬外表面周围的空气中的气体(氮气、氧气、二氧化碳等)可能溶解并扩散到电解液中。这里,我们将除氧气以外的所有气体视为惰性气体。假定氧气与柠檬外表面的周围空气处于平衡状态,它可以从表面扩散到电极,在电极处被还原。氧的扩散过程也可以用Nernst–Planck方程来描述(相当于不带电物质的菲克扩散定律)。在本系统所有的化学反应中,由于氧气还原反应具有最高的平衡电势,因此我们不必考虑氧气的析出。
对氢的传输过程进行建模有些困难。氢的还原/氧化反应平衡电位处于本反应系统的中间值,这意味着该反应可以沿任何方向进行(取决于局部电极电位)。如果在电极上形成氢气气泡,则会使建模复杂化,因为这会在系统中引入第二相(除了液相)。两相系统的建模通常很复杂,对于柠檬果肉,没有直接的方法来描述气泡传输。因此,我们假设所有氢均以气体形式(活度为1)形成,并且假定任何形成的气体在被氧化之前会立即被排出,以简化此过程。在方程式方面,就只能通过假设氢气反应为不可逆的还原反应(析氢)来实现。对于正(氧化/阳极)极过电位,将反应速率设置为 0。这样,模型无需求解氢浓度。
系统边界和几何选择
当包含锌和铜片时,由于这些金属相对于柠檬果肉具有很高的电导率,因此只要将金属的电位建模为边界条件就足够了。结合上文中的讨论可知,所建电池模型完全由电解液(柠檬的果肉)中发生的物理化学现象以及电极表面上的反应决定。因此,我们选择柠檬的外表面(不包括金属域)作为系统边界。
在构建模型几何时,考虑到对称性,我们将柠檬取一半建模以节省计算资源。
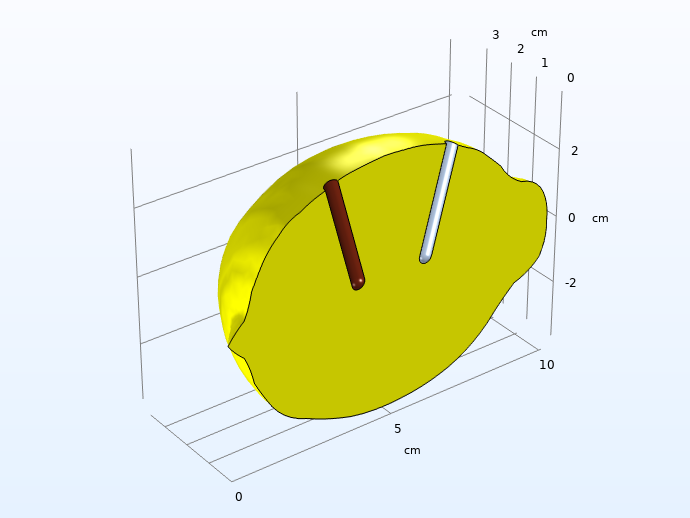
考虑电极的对称性和高电导率后的计算域。
注意:我们始终建议使用尽可能低的维度,因为这通常可以节省模型开发和计算时间。对于实际的柠檬,我们可以考虑围绕中心轴具有轴向对称性的二维几何。由于我们要完全自由地放置电极,因此必须在三维中构建模型。但是,即使在我们的示例中,仍建议以较小的维度开始建模项目,以测试不同的域方程和边界条件并确保它们收敛。例如,该模型适合首先在一维中建模,模拟在电解液中插入两个平面电极,但是在本博客文章中我们省略了此步骤。
在 COMSOL Multiphysics®中模拟柠檬电池
我们使用 COMSOL Multiphysics 中的三次电流分布,支持电解质接口对柠檬电池进行建模,下文显示了建模结果。我们使用恒定的电导率定义电荷传输,通过 Nernst–Planck 方程定义物质传输,基于软件内置的质量作用定律 Butler–Volmer 方程定义电极反应,以及基于 Nernst 方程计算平衡电位。
此处请注意:大多数参数值,尤其是电极动力学的参数值,仅出于示范目的,并非基于文献。
在模拟中,使用的负载循环包括:在初始条件(柠檬营养成分列表值)下搁置 1 min,然后在 0.5 mA 的负载下放电 1 min 分钟,再搁置 1 min。
解释电池运行期间的电压曲线
下图显示了仿真的电压和电流结果。
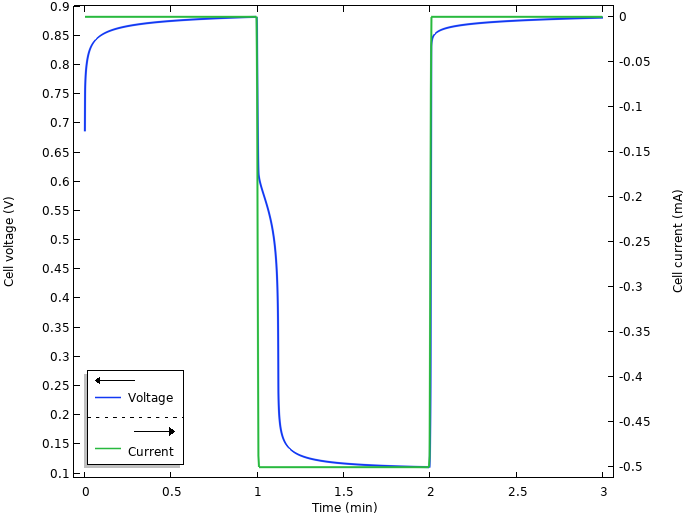
电压和电流。
最初,当将电极插入柠檬中时,似乎会发生某种弛豫,电池电压缓慢升高至 0.9 V。当在 t=1min 时接通电流时,电流会从开路电压下降到约 0.1V 的工作电压。我们还注意到,2min 后电流被切断会有某种弛豫。
将电池电压乘以电流,还可以绘制出电池的功率输出图。
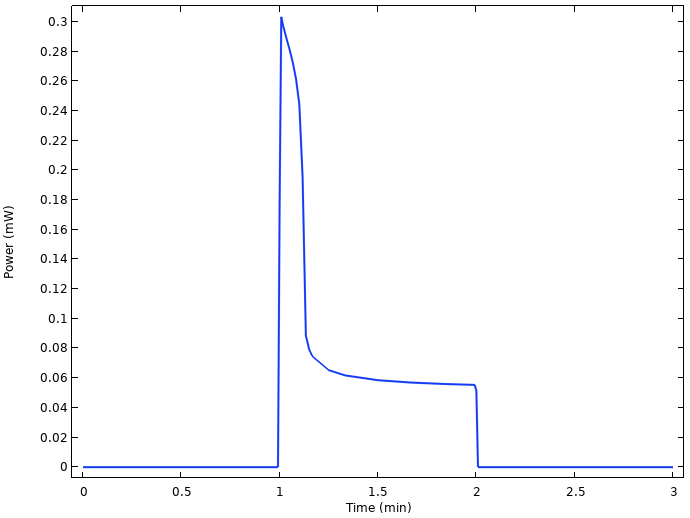
电池输出的功率。
由上图可知,负载接通后仅几秒钟,功率就从 0.3 mW 降低到 0.06 mW,这与电压大幅下降相有关。
当有电流通过时,电池电压下降大约 0.75V。如此巨大的下降(对于电化学家而言)意味着什么?下面,我们通过绘制两个电极端部的电极电位(相对于 SHE)与时间的关系来分析:
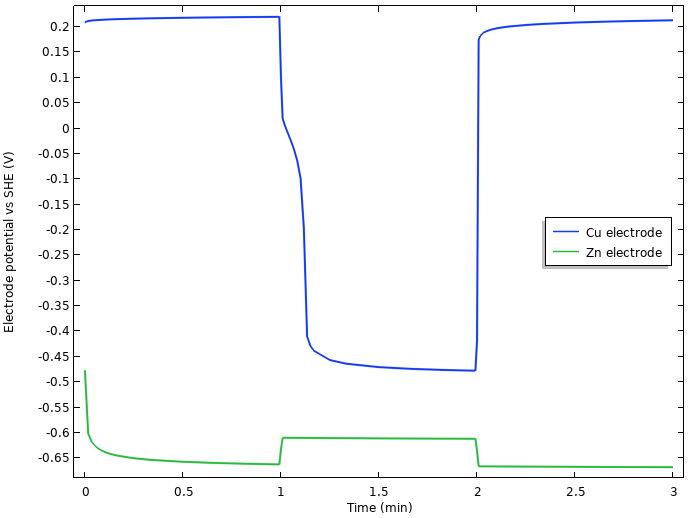
电极电位与 SHE 的关系。注:SHE-标准氢标参比电极
我们注意到,静止时电池电压的初始升高,似乎与负锌电极上发生的现象有关,但是当电流负载开启时,电池电压下降的 0.75 V 似乎大部分都来自于正铜电极。
下图中绘制的铜钉表面的平均氧气浓度与时间的关系揭示了这一现象。
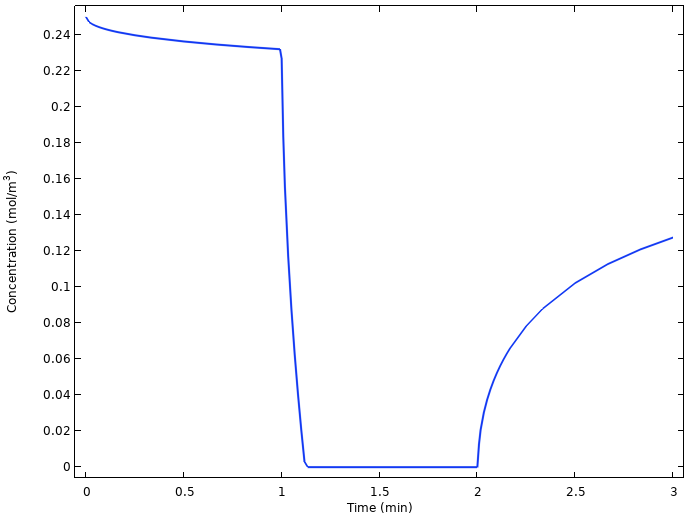
铜电极上的平均氧浓度。
当电流接通时,铜电极上的氧浓度迅速降至零,并在电流再次断开时开始弛豫并恢复到较高的值。原因是一旦打开负载,氧气从柠檬表面到铜电极的缓慢扩散不足以维持电池电流。也就是说,我们在高于氧气还原极限电流的条件下操作电池。
通过绘制整个铜钉表面不同电极反应的局部电流密度的积分,可以进一步解释该现象。
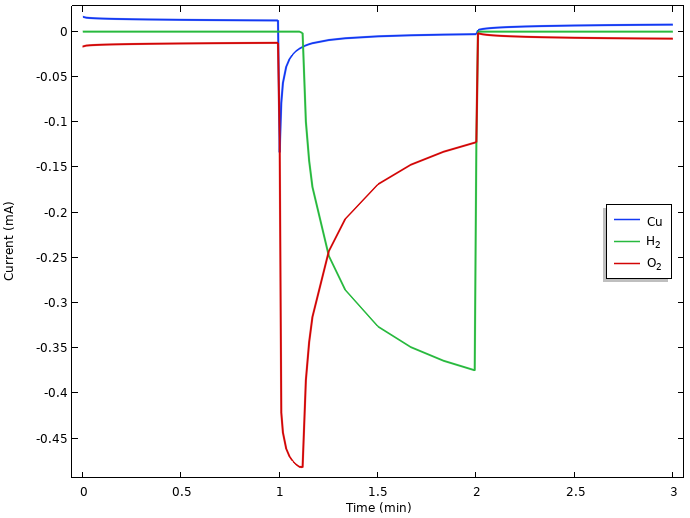
正极的局部电流密度积分。
仔细查看上图中初始搁置期间的电流,我们会发现:铜的溶解速度(小的正电流)与氧的还原速率(小的负电流)相同。这表明在搁置期间会发生持续的铜腐蚀。在最初的搁置期间不存在氢逸出。这是由于析氢的平衡电位低于此时的混合电极电位,其值位于铜溶解和氧还原的平衡电位之间。(但是,如果电极上已经存在氢气,则该氢气会被氧化。不过如前文所述,在任何时候我们都不会假定柠檬中存在氢气。)
接通电流后,我们会看到氧气还原电流出现初始激增,然后随着氧气耗尽而回落。由于我们操作电池的方式,所有电流总和被限制为总计 0.5mA 的电池负载,因此当电极中的氧气用尽时,电位会下降,直到达到低于析氢的电极电位,然后析氢反应才可以介入提供所需的还原电流。由于水的自电离作用和高的水浓度,在电极上有大量的氢离子供应,氢析出的极限电流比氧还原的极限电流高几个数量级。我们还注意到,当负载期间电极电位下降时,铜开始沉积。
因此,我们可以从由搁置状态下的铜溶解-氧还原控制的电极电位过渡到接通负载时析氢控制的电极。从搁置时约 0.2 V vs. SHE 的电极电位到接通时约 -0.45 V vs. SHE 的电极电位,这一较大的电位降可以通过氢气析出的平衡电势显著低于氧气还原的平衡电势来解释。动力学也影响着结果,但这里我们暂时不分析。
负极自放电和电池容量
下图显示了负极上各个电极反应的局部电流密度积分。
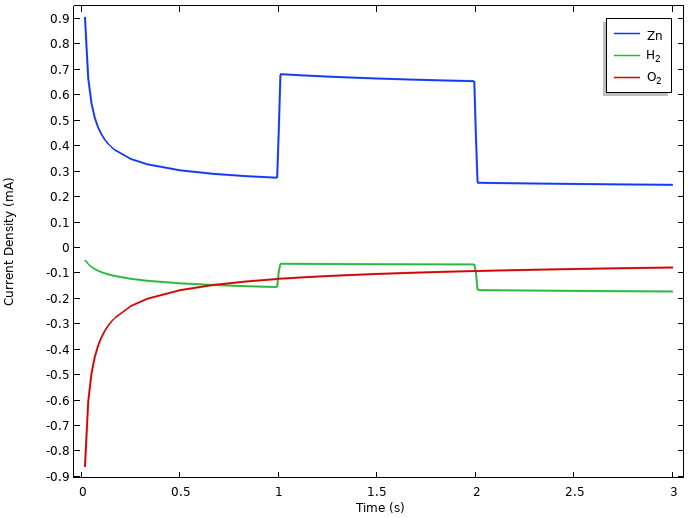
负极上的局部电流密度积分。
在负极上,氧气还原和氢气释放都会导致锌在搁置状态下溶解(最初的弛豫现象与所有这些反应之间的相互作用有关,但在此我们将不再进一步讨论)。
在负载期间,锌的溶出度增加,以匹配 0.5 mA 的电池电流,此外还要加上氧气还原和析氢电流
锌的连续溶解表明,我们放入柠檬中的金属锌的初始质量决定了电池的容量。因为在正极,水的自电离作用将为我们提供几乎无限量的氢离子来源来进行析氢反应。但是,电池能够放电的时长将取决于负载和自放电反应之间的相互作用。
评估电压损失
在负载期间,模型中存在三种主要的电压损耗源:
- 电解液中的欧姆压降
- 驱动锌在负极上溶解的活化过电位
- 驱动正极上析氢反应(或氧还原)的活化过电位
首先,我们绘制了负载脉冲30秒后电解液中的欧姆电压降。
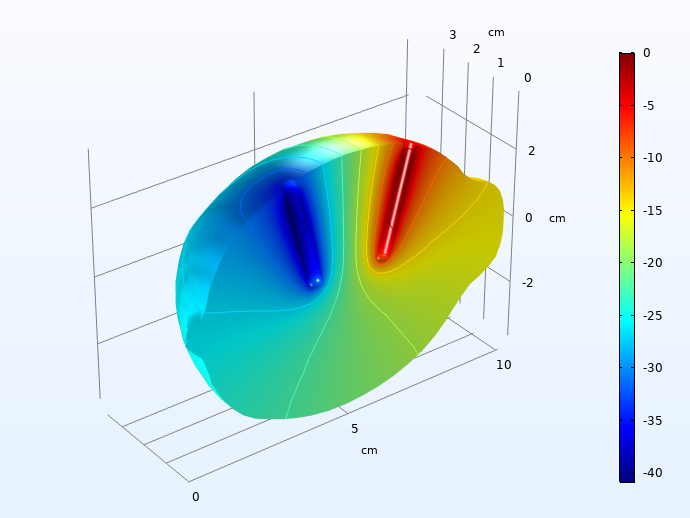
进入充电脉冲 30 秒后,电解液的欧姆电压降(mV)。
40 mV 的电压降很明显,但并不大。
接下来,我们绘制了锌在负极上溶解和氢气在正极上析出的局部过电位。
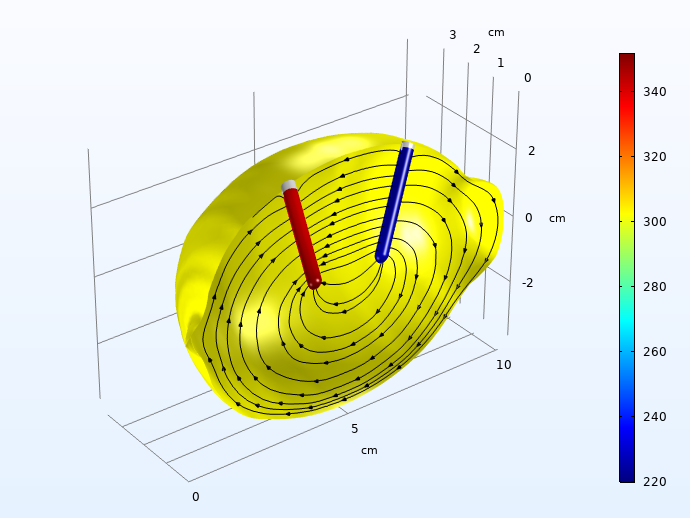
进入充电脉冲 30s 后,氢(左)和锌溶解(右)活化过电位(mV,绝对值)。流线描绘了沿对称平面的电解液电流。
两个电极上的活化过电位在负载脉冲中持续了 30s,总计约 0.5V。远高于电解液中电荷传输的欧姆损耗。
提高功率输出
现在,我们返回到最初的项目建模目标,查看是否可以提高电池的输出功率。
在不更改电极或电解液的情况下,很难实现改善锌电极上固有的电极动力学,以及对电池极化贡献最大的一组参数值。但是,我们可以通过增加可用的电极-电解液界面面积来改善催化活性。这样做的原因是,所有电流都必须通过每个电极上的电极-电解液界面,并且与电极反应相关的电压损耗越高,局部电流密度就越高。通过增加用于电极反应的可用面积,减小了每个电极面积的局部电流密度,进而也减小了相关的电压损耗。
由于柠檬中有大量的可用空间,因此,较大的电极几何区域(或只是更多的电极)应该是提高性能的可行方法。然而,这也将增加自放电,因为这也与活性电极面积直接相关。
如果可以减少电解液中的欧姆压降,电池性能也会稍微提升。实现此目的的一种方法是简单地将电极彼此靠近放置。但是,我们必须谨慎行事,因为这样可能会增加在锌电极上沉积铜的影响——而这可能会使锌电极的动力学降低。但是,我们尚未在模型中包括此类影响。
还有一种方法是,如果能通过某种方式利用铜电极上的氧还原而不是析氢反应放出 0.5 V 的电压(参见上图),则可以使电池性能提升。一种可能的方法是将铜电极放置在更靠近柠檬表面的位置,以缩短氧的扩散距离。
根据上面的建模结果,我们提出以下针对柠檬电池的功率优化设计。

功率优化后的柠檬电池设计。
在此设计中,我们用铜硬币替换了铜钉,还引入了多个电极(柠檬的每个楔形区域配一对电极,总共 12 对)。这里也许应该指出的是,新设计的布线工作将需要相当灵活的手指。
引入多个金属电极会增加电极的总表面积,应该可以以更高的总电流运行电池(原则上,我们现在并行运行了 12 个电池)。引入铜硬币而不是钉子,进一步增加了电极面积,但更重要的是,还增加了位于柠檬表面附近的铜电极表面数量,可以得到更高的氧气还原极限电流。
运行新设计模型的仿真,当总电流为 6 mA(每个楔形区域为 0.5 mA)时,电池电压如下图所示:
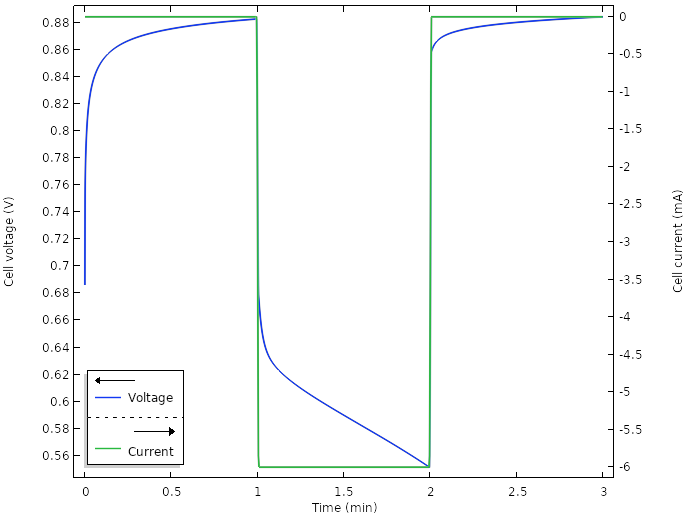
新设计电池的电压和电流。
相应的电池功率结果表明,现在我们能够在高于 1 mW 的功率水平上运行电池:
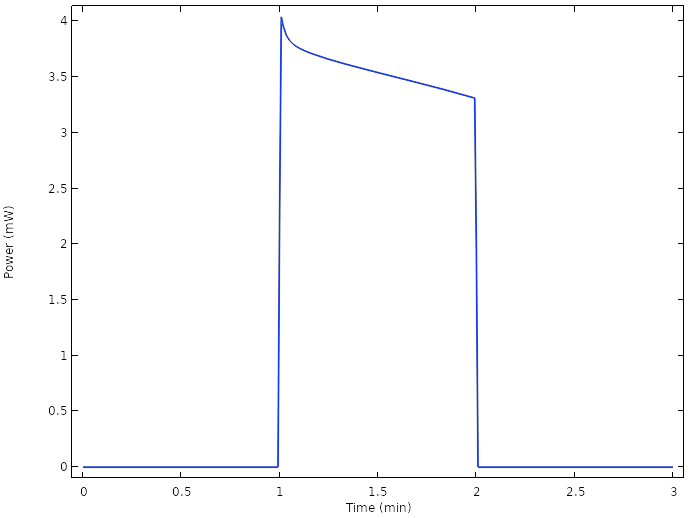
新设计电池的功率。
使功率提升的一个主要的贡献是使用了多个电极,但是绘制电极电位图表明,我们已经设法在输出电压超过 0.5 V 的情况下增加了正极电位。
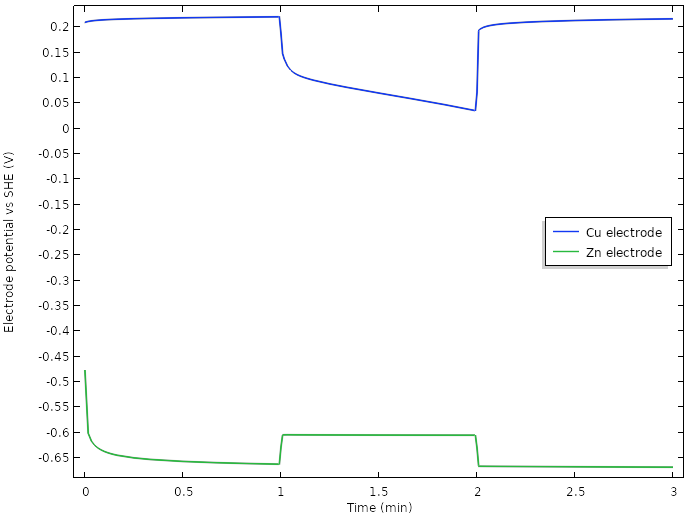
对于新设计电池,电极端部的电极电位与 SHE 的关系。
再次检查铜电极上的氧浓度,我们发现在任何时候都没有将电极上的氧完全耗尽。
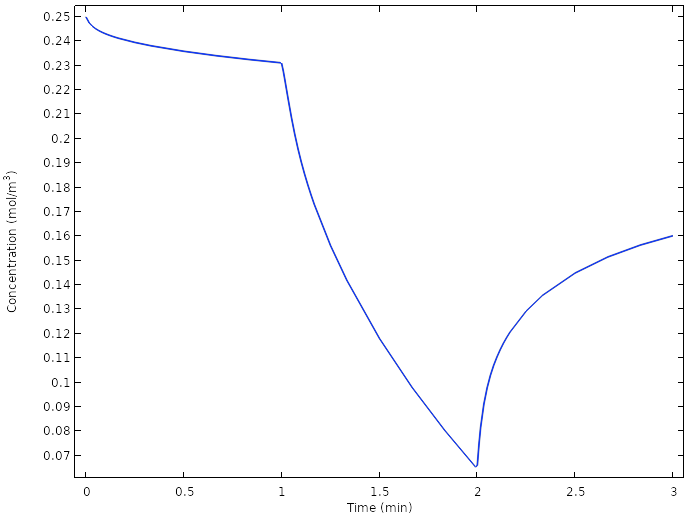
新设计电池铜电极上的平均氧浓度。
相应地,正电极反应电流的曲线表明,负载期间的主要电极反应是氧还原反应。
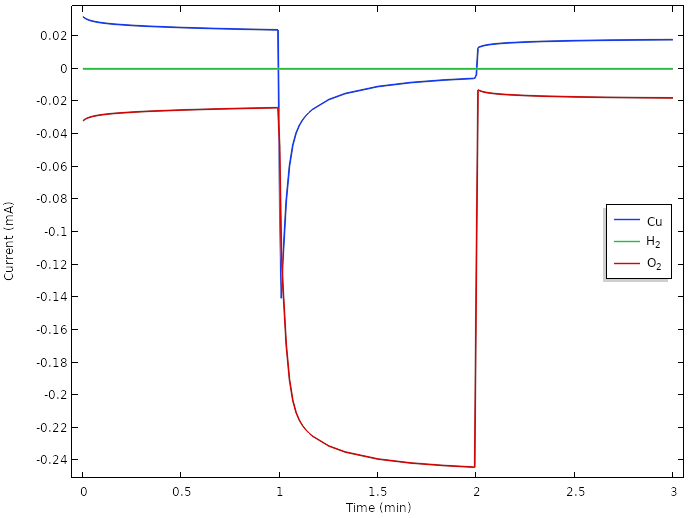
然而,氧浓度和电流都随着时间连续下降。进一步改进的方法是引入疏水性多孔气体扩散介质,以促进氧气在柠檬表面和铜电极之间的传输。由于气相扩散通常比液体扩散快约4~5个数量级,因此这将显著增加氧气的传输。如何执行此操作的详细信息非常适合使用模型来探索。也许,我们还必须将铜金属替换为对氧还原更有活性的物质,例如铂。但是,铂金硬币往往很难获得。
如今,人们已经发明了以这种方式设计的柠檬电池,它被称为锌空气电池,但其电解液是碱性的。
后续操作
对电化学建模的其他示例感兴趣吗?请单击下面的按钮,在 COMSOL “案例库”中探索更多电化学模型。



评论 (2)
兆鑫 周
2023-09-11你好,可以提供一下关于柠檬电池案例的相关文件吗
hao huang
2023-09-12 COMSOL 员工柠檬电池相关案例请参考://www.denkrieger.com/model/lemon-battery-86411